Автор книги: Людмила Белецкая
Жанр: Медицина, Наука и Образование
Возрастные ограничения: +18
сообщить о неприемлемом содержимом
Текущая страница: 3 (всего у книги 14 страниц) [доступный отрывок для чтения: 4 страниц]
Иллюстративный материал
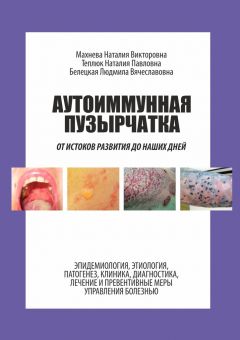
Рисунок 3.1. Заболеваемость аутоиммунной пузырчаткой в некоторых странах мира.

Рисунок 3.1
Библиография
Aboobaker J., Morar N., Ramdial P. K., Hammond M. G. Pemphigus in South Africa // Int. J. Dermatol. – 2001. – Vol. 40. – №2. – P. 115—119.
Ahmed A. R., Park M. S., Tiwari J. L., Terasaki P. I. Association of DR4 with pemphigus // Exp. Clin. Immunogenet. – 1987. – Vol. 4. – №1. – P. 8—16.
Ahmed A. R., Yunis E. J., Khatri K., Wagner R., Notani G., Awdeh Z., Alper C. A. Major histocompatibility complex haplotype studies in Ashkenazi Jewish patients with pemphigus vulgaris // Proc. Nat. Acad. Sci. USA. – 1990. – Vol. 87. – №19. – P. 7658—7662.
Ahmed A. R., Wagner R., Khatri K., Notani G., Awdeh Z., Alper C. A., Yunis E. J. Major histocompatibility complex haplotypes and class II genes in non-Jewish patients with pemphigus vulgaris // Proc. Nat. Acad. Sci. USA. – 1991. – Vol. 88. – №11. – P. 5056—5060.
Ahmed A. R., Mohimen A., Yunis E., Mirza N. M., Kumar V., Beutner E. H., Alper C. A. Linkage of pemphigus vulgaris antibody to the major histocompatibility complex in healthy relatives of patients // J. Exp. Med. – 1993. – Vol. 177. – №2. – P. 419—424.
Alcaide-Martín A. J., Gallardo-Pérez M. A., Castillo-Muñoz R., Mendiola Fernández M. V., Herrera-Ceballos E. Estudio epidemiologico de 20 casos de penfigo en el Hospital Clinico Universitario Virgen de la Victoria de Malaga // Actas Dermosifiliogr. – 2010. – Vol. 101. – №6. – P. 524—533.
Alsaleh Q. A., Nanda A., Al‐Baghli N. M., Dvorak R. Pemphigus in Kuwait // Int. J. Dermatol. – 1999. – Vol. 38. – №5. – P. 351—356.
Amagai M. Pemphigus // Bolognia J. L., Jorizzo J. L., Rapini R. P. Dermatology. – New York: Mosby, 2002. – P. 449—462.
Amagai M. Pénfigo // Bolognia J. L., Jorizzo J. L., Rapini R. P., Horn T. D., Mascaró J. M., Mancini A. J., ed. Dermatología. – Madrid: Elsevier España S.A., 2004. – P. 449—462.
Aoki V., Millikan R. C., Rivitti E. A., Hans-Filho G., Eaton D. P., Warren S. J., Li N., Hilario-Vargas J., Hoffmann R. G., Diaz L. A. Environmental risk factors in endemic pemphigus foliaceus (fogo selvagem) // J. Investig Dermatol. Symp. Proc. – 2004. – Vol. 9. – №1. – P. 34—40.
Asilian A., Yoosefi A., Faghini G. Pemphigus vulgaris in Iran: epidemiology and clinical profile // Skinmed. – 2006. – Vol. 5. – №2. – P. 69—71.
Birol A., Anadolu R. Y., Tutkak H., Gürgey E. HLA‐class 1 and class 2 antigens in Turkish patients with pemphigus // Int. J. Dermatol. – 2002. – Vol. 41. – №2. – P. 79—83.
Bordel-Gómez M. T., Sánchez-Estella J., Yuste-Chaves M., Santos-Durán J. C., Alonso-San Pablo M. T. [Familial pemphigus vulgaris: immunogenetic study of HLA class II antigens] // Actas Dermosifiliogr. – 2006. – Vol. 97. – №8. – P. 509—513.
Brandsen R., Frusic-Zlotkin M., Lyubimov H., Yunes F., Michel B., Tamir A., Milner Y., Brenner S. Circulating pemphigus IgG in families of patients with pemphigus: comparison of indirect immunofluorescence, direct immunofluorescence and immunoblotting // J. Am. Acad. Dermatol. – 1997. – Vol. 36. – №1. – P. 44—52.
Bystryn J.-C., Rudolph J. L. Pemphigus // Lancent. – 2005. – Vol. 366. – №9479. – P. 61—73.
Coronel-Pérez I. M., Rodriguez-Rey E. M., Pérez-Bernal A. M., Camacho F. M. Epidemiologia del penfigo en el Hospital Universitario Virgen Macarena (2005—2006) // Actas Dermosifiliogr. – 2009. – №2. – Vol. 100. – P. 121—125.
Delgado J. C., Hameed A., Yunis J. J., Bhol K., Rojas A. I., Rehman S. B., Khan A. A., Ahmad M., Alper C. A., Ahmed A. R., Yunis E. J. Pemphigus vulgaris autoantibody response is linked to HLA-DQB1*0503 in Pakistani patients // Hum. Immunol. – 1997. – Vol. 57. – №2. – P. 110—119.
Diaz L. A., Sampaio S. A. P., Rivitti E. A., Martins C. R., Cunha P. R., Lombardi C., Almeida F. A., Castro R. M., Macca M. L., Lavrado C., Filho G. H., Borges P., Chaul A., Minelli L., Empinotti J. C., Friedman H., Campbell I., Labib R. S., Anhalt G. J. Endemic pemphigus foliaceus (Fogo selvagem): II. Current and historic epidemiologic studies // J. Am. Acad. Dermatol. – 1989. – Vol. 92. – №1. – P. 4—12.
Esmaili N., Chams-Davatchi C., Valikhani M., Daneshpazhooh M., Balighi K., Hallaji Z., Barzegari M., Akhyani M., Ghodsi Z. S., Mrotazavi H., Naraghi Z. S., Toosi S. Pemphigus vulgaris in Iran: a clinical study of 140 cases // Int. J. Dermatol. – 2007. – Vol. 46. – №11. – P. 1166—1170.
Feldman S. Pemphigus in brothers // Arch. Dermatol. Syph. – 1936. – Vol. 33. – №4. – P. 730.
Firooz A., Mazhar A., Ahmed A. R. Prevalence of autoimmune diseases in the family members of patients with pemphigus vulgaris // J. Am. Acad. Dermatol. – 1994. – Vol. 31. – №3. – P. 434—437.
Hafeez Z. H. Pemphigus in Pakistan, a study of 108 cases // J. Pak. Med. Assoc. – 1998. – №1. – Vol. 48. – P. 9—10.
Hans-Filho G., dos Santos V., Katayama J. H., Aoki V., Rivitti E. A., Sampaio S. A., Friedman H., Moraes J. R., Moraes M. E., Eaton D. P., Lopez A. L., Hoffman R. G., Fairley J. A., Giudice G. J., Diaz L. A. An active focus of high prevalence of fogo selvagem on an Amerindian reservation in Brazil // J. Invest. Dermatol. – 1996. – Vol. 107. – №1. – P. 68—75.
Hashimoto K., Miki Y., Nakata S., Matsuyama M. HLA-A10 in pemphigus among Japanese // Arch. Dermatol. – 1977. – Vol. 113. – №11. – P. 1518—1519.
Hietanen J., Salo O. P. Pemphigus: an epidemiological study of patients treated in Finnish hospitals between 1969 and 1978 // Acta Dermatol. Venereol. – 1982. – Vol. 62. – №6. – P. 491—496.
Hilario-Vargas J., Dasher D. A., Li N., Aoki V., Hans-Filho G., dos Santos V., Qaqish B. F., Rivitti E. A., Diaz L. A. Prevalence of anti-desmoglein-3 antibodies in endemic regions of Fogo selvagem in Brazil // J. Invest. Dermatol. – 2006. – Vol. 126. – №9. – P. 2044—2048.
Kallel Sellami M., Ben Ayed M., Mouquet H., Drouot L., Zitouni M., Mokni M., Cerruti M., Turki H., Fezza B., Mokhtar I., Ben Osman A., Zahaf A., Kamoun M. R., Joly P., Masmoudi H., Makni S., Tron F., Gilbert D. Anti‐desmoglein 1 antibodies in Tunisian healthy subjects: arguments for the role of environmental factors in the occurrence of Tunisian pemphigus foliaceus // Clin. Exp. Immunol. – 2004. – Vol. 137. – №1. – P. 195—200.
Kanwar A. J., Ajith A. C., Narang T. Pemphigus in north India // J. Cutan. Med. Surg. – 2006. – Vol. 10. – №1. – P. 21—25.
Krain L. S., Terasaki P. I., Newcomer V. D., Mickey M. R. Increased frequency of HL-A10 in pemphigus vulgaris // Arch. Dermatol. – 1973. – Vol. 108. – №6. – P. 803—805.
Kricheli D., David M., Frusic‐Zlotkin M., Goldsmith D., Rabinov M., Sulkes J., Milner Y. The distribution of pemphigus vulgaris‐IgG subclasses and their reactivity with desmoglein 3 and 1 in pemphigus patients and their first‐degree relatives // Br. J. Dermatol. – 2000. – Vol. 143. – №2. – P. 337—342.
Loiseau P., Lecleach L., Prost C., Lepage V., Busson M., Bastuji-Garin S., Roujeau J. C., Charron D. HLA class II polymorphism contributes to specify desmoglein derived peptides in pemphigus vulgaris and pemphigus foliaceus // J. Autoimmun. – 2000. – Vol. 15. – №1. – P. 67—73.
Lombardi C., Borges P. C., Chaul A., Sampaio S. A. P., Rivitti E. A., Friedman H. et al. Environmental risk factors in endemic pemphigus foliaceus (fogo selvagem) // J. Invest. Dermatol. – 1992. – Vol. 98. – №6. – P. 847—850.
Lombardi M. L., Mercuro O., Ruocco V., Lo Schiavo A., Lombari V., Guerrera V., Pirozzi G., Manzo C. Common human leukocyte antigen alleles in pemphigus vulgaris and pemphigus foliaceus Italian patients // J. Invest. Dermatol. – 1999. – Vol. 113. – №1. – P. 107—110.
Mahé A., Flageul B., Cissé I., Kéita S., Bobin P. Pemphigus in Mali: a study of 30 cases // Br. J. Dermatol. – 1996. – Vol. 134. – №1. – P. 114—119.
Matzner Y., Erlich H. A., Brautbar C., Sanilevitch A., Landau M., Brenner S., Friedmann A. Identical HLA class II alleles predispose to drug-triggered and idiopathic pemphigus vulgaris // Acta Derm. Venereol. – 1995. – Vol. 75. – №1. – P. 12—14.
Micali G., Musumeci M. L., Nasca M. R. Epidemiologic analysis and clinical course of 84 consecutive cases of pemphigus in eastern Sicily // Int. J. Dermatol. – 1998. – Vol. 37. – №3. – P. 197—200.
Mimouni D., Bar H., Gdalevich M., Katzenelson V., David M. Pemphigus – analysis of epidemiological factors in 155 patients // J. Eur. Acad. Dermatol. Venereol. – 2008. – Vol. 22. – №10. – P. 1232—1235.
Miyagawa S., Niizeki H., Yamashina Y., Kaneshige T. Genotyping for HLA-A, B and C alleles in Japanese patients with pemphigus: prevalence of Asian alleles of the HLA-B15 family // Br. J. Dermatol. – 2002. – Vol. 146. – №1. – P. 52—58.
Moraes J. R., Moraes M. E., Fernandez-Vina M., Diaz L. A., Friedman H., Campbell I. T., Alvarez R. R., Sampaio S. A., Rivitti E. A., Stastny P. HLA antigens and risk for development of pemphigus foliaceus (fogo selvagem) in endemic areas of Brazil // Immunogenetics. – 1991. – Vol. 33. – №№5—6. – P. 388—391.
Niizeki H., Inoko H., Mizuki N., Inamoto N., Watababe K. Hashimoto T., Nishikawa T. HLA-DQA1, -DQB1 and -DRB1 genotyping in Japanese pemphigus vulgaris patients by the PCR-RFLP method // Tissue antigens. – 1994. – Vol. 44. – №4. – P. 248—251.
Pérez-Bernal A. M., Moreno J. C., Camacho F. Ten years’ experience of the treatment of 34 cases of pemphigus // J. Dermatolog Treat. – 1992. – №3. – P. 73—75.
Reohr P. B., Mangklabruks A., Janiga A. M., DeGroot L. J., Benjasuratwong Y., Soltani K. Pemphigus vulgaris in siblings: HLA-DR and HLA-DQw3 and susceptibility to pemphigus // J. Am. Acad. Dermatol. – 1992. – Vol. 27. – №2. – P. 189—193.
Rivera R., Postigo C., de la Mano D., Vanaclocha F., Iglesias L. Penfigo: estudio retrospectivo de 52 casos // Actas Dermosifiliogr. – 2004. – Vol. 95. – P. 213—218.
Sáenz‐Cantele A. M., Fernández‐Mestre M., Montagnani S., Calebotta A., Balbas O., Layrisse Z. HLA‐DRB1* 0402 haplotypes without DQB1* 0302 in Venezuelan patients with pemphigus vulgaris // Tissue antigens. – 2007. – Vol. 69. – №4. – P. 318—325.
Salmanpour R., Shahkar H., Namazi M. R., Rahman-Shenas M. R. Epidemiology of pemphigus in south-western Iran: a 10-year restrospective study (1991—2000) // Int. J. Dermatol. – 2006. – Vol. 45. – №2. – P. 103—105.
Sánchez-Pérez J., García-Díez A. Pénfigo // Actas Dermosifiliogr. – 2005. – Vol. 96. – №6. – P. 329—356.
Sinha A. A., Brautbar C., Szafer F., Friedmann A., Tzfoni E., Todd J. A., Steinman L., McDevitt H. O. A newly characterized HLA DQ beta allele associated with pemphigus vulgaris // Science. – 1988. – Vol. 239. – №4843. – P. 1026—1029.
Stanley J. R. Pemphigus // Fitzpatrick’s Dermatology in General Medicine. 6th edition. – USA: Ed. Mc Graw Hill, 2003. – P. 558—574.
Tallab T., Joharji H., Bahamdan K., Karkashan E., Mourad M., Ibrahim K. The incidence of pemphigus in the southern region of Saudi Arabia // Int. J. Dermatol. – 2001. – Vol. 40. – №9. – P. 570—572.
Tsankov N., Vassileva S., Kamarashev J., Kazandjieva J., Kuzeva V. Epidemiology of pemphigus in Sofia, Bulgaria. A 16-year retrospective study (1980—1995) // Int. J. Dermatol. – 2000. – Vol. 39. – №2. – P. 104—108.
V’lckova‐Laskoska M. T., Laskoski D. S., Kamberova S., Caca‐Biljanovska N., Volckova N. Epidemiology of pemphigus in Macedonia: A 15‐year retrospective study (1990—2004) // Int. J. Dermatol. – 2007. – Vol. 46. – №3. – P. 253—258.
Warren S. J. P., Lin M. S., Giudice G. J., Hoffmann R. G., Hans-Filho G., Aoki V., Rivitti E. A., Santos V., Diaz L. A. The prevalence of antibodies against desmoglein 1 in endemic pemphigus foliaceus in Brazil // N. Engl. J. Med. – 2000. – Vol. 343. – №1. – P. 23—30.
Yazganoğlu K. D., Baykal C., Küçükoğlu R. Childhood pemphigus vulgaris: five cases in 16 years // J. Dermatol. – 2006. – Vol. 33. – №12. – P. 846—849.
Глава 4.
Иммуннопатология аутоиммунной пузырчатки
Накопленные фундаментальные знания об этом угрожающем жизни заболевании позволяют не сомневаться в истинной картине аутоиммунного происхождения пузырчатки, которую можно представить как парадигму специфического аутоиммунного заболевания органов [Stanley J. R., 1989; Thivolet J., Nicolas J. F., 1995]. Об этом свидетельствует присутствие всех признаков (клинических, цитологических, гистологических, иммунологических и иммуногистохимических), характерных для аутоиммунных заболеваний [Махнева Н. В., Белецкая Л. В., 2012; Vaillant L., 1991]:
• существование специфических аутоантител;
• появление идентичных кожных поражений у новорожденных от беременных, страдающих пузырчаткой;
• сочетание с другими аутоиммунными и иммунопатологическими процессами (например, сахарный диабет II типа, аутоиммунный тиреоидит, ревматоидный полиартрит, анемия, бронхиальная астма, аутоиммунный миокардит, миастения гравис и др.);
• присутствие особого активного генетического участка (выявление определенных гаплотипов главного комплекса гистосовместимости II класса).
Аутоантитела при аутоиммунной пузырчатке
Основным механизмом развития аутоиммунной пузырчатки является потеря связи (адгезии) между кератиноцитами (акантолиз) с последующим образованием внутриэпидермальных пузырей [Глухенький Б. Т., Грандо С. А., 1990; Ежов Н. Я., 1974; Матушевская Е. В., 1997; Потекаев Н. С., 2004; Цветкова Г. М. с соавт., 2003; Beutner E. H. et al., 1973; Iwatsuki K. et al., 1989]. Разрыв связей между клетками эпидермиса возникает в результате воздействия аутоантител на антигены межклеточной субстанции (белков десмосомального аппарата, молекул адгезии) многослойного плоского эпителия (кожа, слизистая оболочка полости рта, пищевода и других органов) (рис. 4.1). Они обладают высокой тканевой специфичностью и относятся к классу иммуноглобулина (Ig) G (рис. 4.2, a). Антитела не реагируют ни с одним из антигенов тканей других органов, кроме антигенов межклеточной субстанции эпителия телец Гассаля тимуса человека и животных (рис. 4.2, b) [Белецкая Л. В., Гнездицкая Э. В., 1974].
Все клинические формы аутоиммунной пузырчатки характеризуются присутствием в крови аутоантител и фиксацией в межклеточных пространствах эпидермиса иммуноглобулина класса G (рис. 4.2, с). Вместе с тем при разных формах пузырчатки уровень и интенсивность фиксации аутоантител в эпителии кожи иммуноглобулина различны. Наиболее интенсивная фиксация антител в эпидермисе наблюдается при вульгарной пузырчатке и выявляется у 70—90% больных [Bhol K. et al., 1994; Bystryn J.-C., Rudolph J. L., 2005; David M. et al., 1989; Jones C. C. et al., 1988]. Циркулирующие межклеточные антитела отмечаются у 80% пациентов с активным патологическим процессом. При этом их титры, определяемые непрямым методом иммунофлюоресценции, обычно коррелируют с активностью болезни [Fitzpatrick R. E., Newcomer V. D., 1980; Friedman H. et al., 1989; Sams W. M. Jr., Jordon R. E., 1971; Squiquera H. L. et al., 1988]. В то же время имеются сообщения некоторых ученых, которые не всегда выявляли корреляцию титра антител к антигенам межклеточной субстанции с активностью или тяжестью течения аутоиммунной пузырчатки [Махнева Н. В., Белецкая Л. В., 2012; de Messias I. T. et al., 1988]. Отсутствие корреляции титра антител к антигенам межклеточной субстанции с активностью или тяжестью течения заболевания связано со способностью кожи сорбировать иммунные комплексы с целью их элиминации, поэтому при обширных поражениях кожи, порой с захватом целых анатомических областей и слизистой оболочки, циркулирующие аутоантитела не всегда удается выявить. И наоборот, в случае локального патологического процесса титр аутоантител может достигать высоких цифр (до 1:10240). На основании полученных результатов исследования предложена теория, что подобные изменения объясняются прочностью гистогематического барьера между кровотоком и тканями у некоторых больных [Махнева Н. В., Белецкая Л. В., 2012].
Отмечено также, что присутствие циркулирующих антител у беременных женщин, страдающих аутоиммунной пузырчаткой, является причиной появления подобных поражений у новорожденных, которые исчезают у последних через несколько недель [Kalyan B., Raghubir B., 1994; Merlob P. et al., 1986; Okano M. et al., 1990; Rocha-Alvarez R. et al., 1992; Storer J. S. et al., 1982]. Передача болезни плацентарным (пассивным) путем от матери к ребенку является весомым аргументом в пользу эксклюзивной роли антител класса IgG в появлении поражений, характерных для аутоиммунной пузырчатки [Amer Y. B., Al Ajroush W., 2007; Fenniche S. et al., 2006; Tope W. D. et al., 1993; Wasserstrum N., Laros R. K., 1983].
Впервые присутствие аутоантител в сыворотке крови больных пузырчаткой было показано Beutner E. N. и Jordon R. E. (1964), а в дальнейшем подтверждено экспериментально Michel B. и Schiltz J. R. (1974, 1976), Hashimoto K. и соавт. (1982, 1983). Индукция акантолиза в культуре клеток кератиноцитов с использованием сывороток больных, страдающих пузырчаткой, выявила способность IgG-антител вульгарной пузырчатки самостоятельно, без присутствия комплемента, вызывать потерю межклеточной адгезии. Результаты исследований, полученные in vitro этими авторами, были подтверждены экспериментально in vivo на новорожденных мышах [Anhalt G. J. et al., 1982; Cirillo N. et al., 2007; Juhasz I. et al., 1993].
Акантолиз у новорожденных мышей был вызван введением сыворотки крови, содержащей IgG больных в активной стадии вульгарной пузырчатки, тогда как сыворотки крови, содержащие IgG больных вульгарной пузырчаткой в стадии ремиссии и здоровых доноров с HLA-ассоциацией с вульгарной пузырчаткой, не провоцировали развитие акантолиза [Amagai M. et al.,1991]. Это свидетельствует о том, что клиническое проявление заболевания является прямым следствием воздействия аутоантител [Anhalt G. J. et al., 1982, 1986]. Дополнительным подтверждением роли IgG явились исследования in vitro, в которых при культивировании человеческой кожи с добавлением IgG из сыворотки крови больных вульгарной пузырчаткой был продемонстрирован акантолиз [Woo T. Y. et al., 1983].
Таким образом, роль IgG-аутоантител в патогенезе аутоиммунной пузырчатки не оспаривается. Однако не менее важным и интересным моментом в изучении механизмов развития данной патологии является определение значения субклассов IgG, которые отличаются друг от друга аминокислотным составом и биологическими свойствами.
Субклассовая характеристика иммуноглобулина класса G
при аутоиммунной пузырчатке
Известно, что IgG составляет около 75% антител сыворотки крови и включает в себя 4 субкласса (IgG1, IgG2, IgG3, IgG4) [Stanworth D. R., Turner M. W., 1978]. Наиболее часто (67% от общего уровня IgG) в сыворотке крови человека выявляется субкласс IgG1. На долю IgG2, IgG3 и IgG4 приходится 22, 7 и 4% соответственно.
Известно, что субклассы IgG ассоциируются с различными функциональными и антигенными свойствами, поэтому их роль отличается в развитии некоторых патологических процессов. Так, IgG1, IgG2, IgG3 способны связывать комплемент, в отличие от IgG4, который его не связывает. При этом все субклассы IgG проходят через плацентарный барьер и участвуют во вторичном иммунном ответе, нейтрализуя действия токсинов и вирусов. Антитела субклассов IgG1 и IgG3 вырабатываются в ответ на белковые антигены, а IgG2 и IgG4-антитела – на антигены гликопротеиновой природы [Schroeder H. W., Cavacini L., 2010; Schur P. H., 1987].
При исследовании сыворотки крови больных пузырчаткой у большинства пациентов были обнаружены все 4 субкласса IgG-антител. Исследователи выдвинули предположение, что IgG-антитела пузырчатки содержат все 4 вида субклассов [Kanwar A. J. et al., 1997]. Однако дальнейшее изучение проблемы выявило различное распределение субклассов IgG в образцах сыворотки больных пузырчаткой [Bhol K. et al., 1995; David M. et al., 1989]. Так, на развитие эндемической листовидной пузырчатки наибольшее влияние оказывают IgG4-аутоантитела [Rock B. et al., 1989]. При других клинических формах пузырчатки основным субклассом является IgG1; а IgG4 – самый редкий субкласс, он встречается реже, чем IgG2 и IgG3 [Bhol K. et al., 1994]. Напротив, в исследованиях того же времени непрямым методом иммунофлюоресценции во всех случаях продемонстрировали преобладание специфичных IgG4-аутоантител, тогда как IgG1-антитела обнаруживались лишь в части сывороток при более низком разведении, IgG2 не определялся, а IgG3-антитела выявлялись крайне редко [Jones C. C. et al., 1988]. Подобной диссоциацией иммуноглобулинов пытались объяснить различные клинические проявления у больных аутоиммунной пузырчаткой.
Во многих исследованиях было показано, что у пациентов в активной стадии вульгарной пузырчатки выявляются высокие титры IgG1 и IgG4-аутоантител, что свидетельствует об их патогенетической роли при данном заболевании [Bhol K. et al., 1994; Rock B. et al., 1989; Warren S. J. P. et al., 2003]. Другие авторы свидетельствуют о том, что гуморальный ответ в активной стадии вульгарной пузырчатки обусловлен чаще субклассом IgG4, а в стадии ее ремиссии – IgG1 [David M. et al., 1989].
При листовидной пузырчатке распределение субклассов IgG сходно с таковым при вульгарной пузырчатке: в стадии активного процесса преобладают IgG4-аутоантитела, а в доклинической стадии и стадии ремиссии болезни – IgG1 [Hacker-Foegen M. K. et al., 2002; Li N. et al., 2003; Rock B. et al., 1989; Warren S. J. P. et al., 2003]. Пациенты с длительной клинической ремиссией, их здоровые родственники и здоровая группа контроля имеют низкие титры IgG1-аутоантител к эпидермальным белкам [Bhol K. et al., 1994]. Выявление низких титров IgG1 в контрольной группе у здоровых лиц можно объяснить тем, что они являются наиболее распространенным среди всех субклассов IgG [Schroeder H. W., Cavacini L., 2010]. Ряд исследователей [David M. et al., 1989] отмечают интересный факт – если IgG1 определялся только на ранних стадиях клинических проявлений аутоиммунной пузырчатки, то IgG4 обнаруживался на протяжении всего периода болезни. Эти результаты позволяют предположить, что переход от доклинической стадии в клиническую стадию заболевания, а также переход заболевания от стадии ремиссии к активному процессу тесно связаны с переходом субклассов от IgG1 к IgG4. Кроме того, полученные результаты показывают, что IgG1-антитела сами по себе не в состоянии вызвать болезнь. Так, Lin M. S. и соавт. (2001) установили, что IgG1-антитела здорового человека, имеющего только IgG1-ответ, не способны вызвать клинические проявления болезни в экспериментальной модели на животных (мыши) при их введении в дозе 15 мг/кг. Вместе с тем IgG4-антитела больных пузырчаткой способны спровоцировать развитие болезни при использовании малых доз IgG4-антител (1,5 мг/кг), т. е. при концентрации в 10 раз меньшей, чем при введении IgG1-антител.
Таким образом, работы многих исследователей установили, что IgG4 является доминирующим субклассом в патогенезе пузырчатки. В период активности болезни отмечено высокое (до 85% случаев) содержание в сыворотках больных пузырчаткой как IgG1, так и IgG4, а в период ремиссии одни авторы подчеркивают значительное (до 79% случаев) содержание IgG4, другие констатировали наличие только IgG1 [Bhol K. et al., 1994; David M. et al., 1989; Jones C. C. et al., 1988; Sampaio S. A. et al., 1994; Trémeau-Martinage C. et al., 1995]. Возможно, подобное явление объясняется генетическими особенностями организма больного. Исследования позволили также предположить, что снижение концентрации IgG3 и C3 компонента комплемента могут предшествовать началу ремиссии заболевания [David M. et al., 1989]. Следует отметить, что большинство сывороток больных пузырчаткой, содержащих IgG1-IgG3-антитела в различных образцах, не показывали усиления активности комплемента, в то время как сыворотки, содержащие только IgG4, обнаруживали фиксацию компонентов комплемента.
В 70-е гг. прошлого столетия методом хроматографии было показано, что сыворотки больных пузырчаткой, в состав которых входили все четыре субкласса IgG, никогда не фиксировали комплемент [Sams W. M. Jr., Schur P. H., 1973]. Это явление характерно для формирования неполных иммунных комплексов. Многочисленные исследования демонстрируют, что IgG-фракции больных пузырчаткой самостоятельно, без участия комплемента, индуцируют акантолиз в культуре ткани [Farb R. M. et al., 1978; Schiltz J., Michel B., 1976; Singer K. H. et al., 1980]. Высокая концентрация IgG в тканях способствует освобождению протеаз, активации плазминогена и вовлечению их в патологический процесс [Hashimoto K. et al., 1983; Morioka S. et al., 1984]. Экспериментально продемонстрировано, что очищенный ингибитор активатора плазминогена 2 плаценты человека может предотвращать в культуре клеток акантолитические изменения, индуцируемые IgG-антителами пузырчатки [Hashimoto K. et al., 1989].
По нашим данным при изучении субклассовой характеристики циркулирующих IgG-аутоантител в сыворотке крови больных было выявлено, что у всех (100%) больных независимо от клинической формы и стадии развития пузырчатки присутствовали IgG2-аутоантитела и в 86,2% случаях – IgG4-аутоантитела [Махнева Н. В. с соавт., 2013]. Преобладание IgG2/IgG4-аутоантител свидетельствует о хронической антигенной стимуляции, преимущественно гликопротеиновой природы. IgG1 и IgG3-аутоантитела выявлены в 60,1 и 41,4% случаев соответственно (рис. 4.3).
Следует отметить, что IgG4-аутоантитела являются доминирующим субклассом на всем протяжении развития заболевания с наибольшей активностью в стадии обострения (100%). IgG1-аутоантитела проявляли наибольшую (75%) активность при впервые выявленной патологии. Вместе с тем оба указанных субкласса присутствуют и играют ключевую роль на протяжении всего периода развития болезни [Махнева Н. В. с соавт., 2013]. Об этом свидетельствуют циркулирующие аутоантитела в сыворотке больных аутоиммунной пузырчаткой в стадии ее клинической ремиссии с доминирующими (71,4%) IgG4-аутоантителами. Циркулирующие IgG1 и IgG3-антитела выявлены в данный период болезни с одинаковой частотой (по 28,6%). Таким образом, выявление выраженной иммунофлюоресцентной реакции с IgG4 и/или IgG1-аутоантителами еще раз подтверждает основную патогенетическую роль данных аутоантител в развитии и течении аутоиммунной пузырчатки.









































